Hallo zusammen
Ich habe hier noch einen zweiten Rötling, an dem ich mir die Zähne ausbeisse.
Habitat gleich wie bei E. subcuboideum (er wuchs direkt daneben): Magere Waldwiese, Picea, Pinus, Betula in Reichweite.
Möglicherweise auch Flaumeichen, die gibt es in dem Wald auch, ich weiss aber nicht ob eine in der Nähe wuchs.
750m auf Kalk.

Durchmesser bis etwa 15 mm. Lamellen meist mit Zahn herablaufend. Hut schwach genabelt. Geruch mehlig.

Stiel auf ganzer Länge fein überfasert.
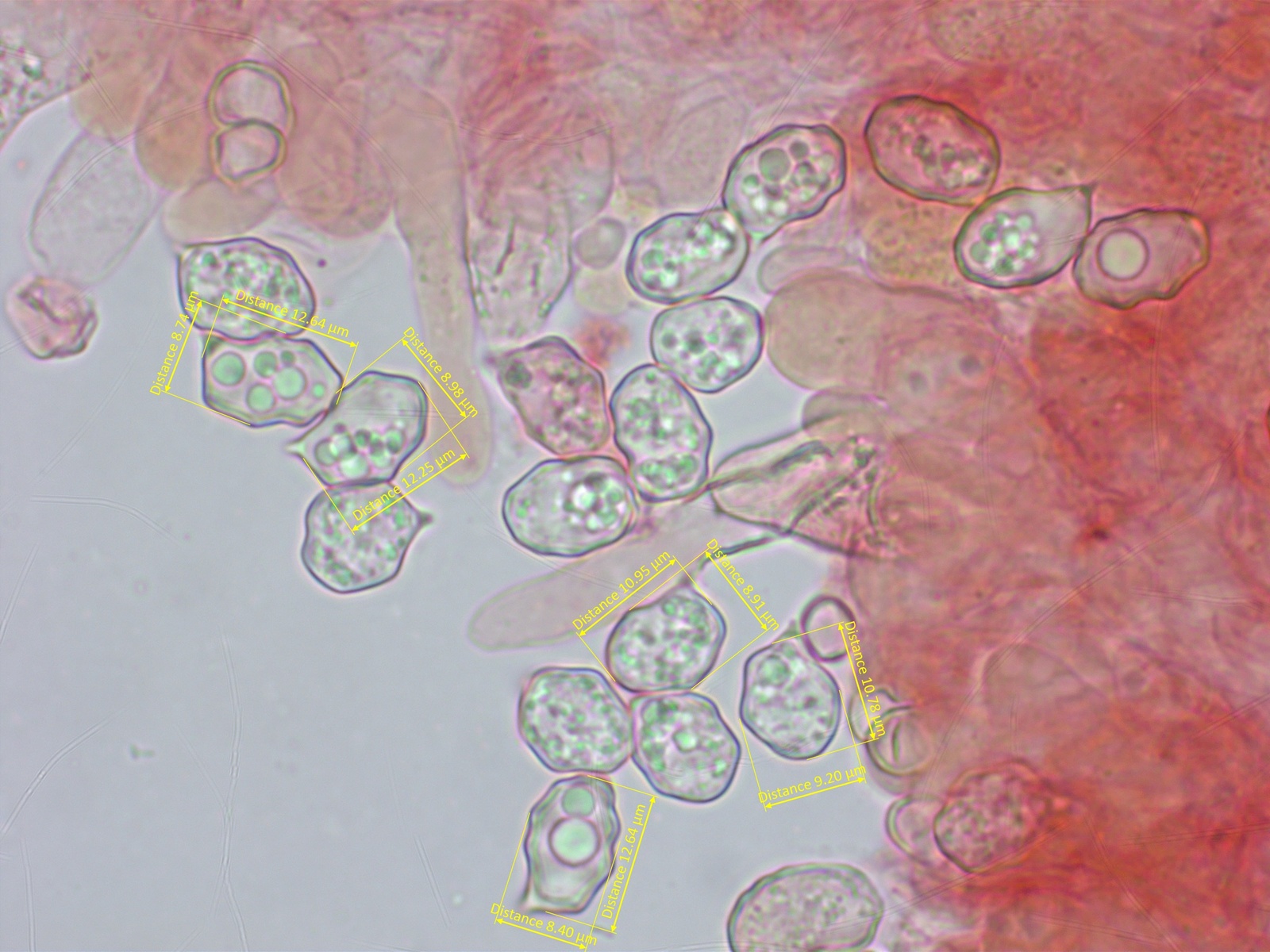
Sporen heterodiametrisch, recht gross, etwa 10.5-13 x 8.5-9.5 µm. Teilweise eher wellig-höckerig als eckig.
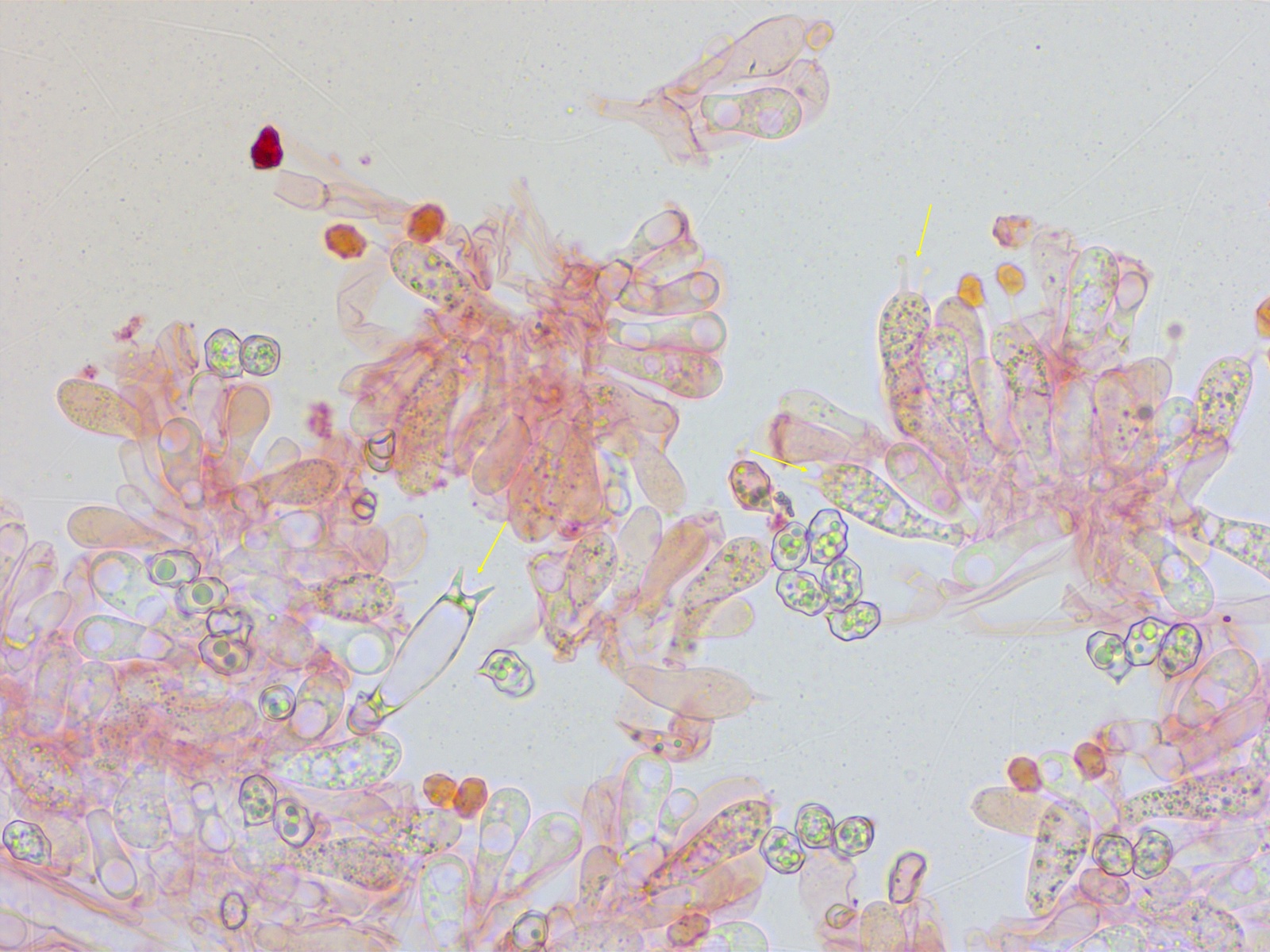
Zuerst dachte ich die Basidien seien rein 2sporig.
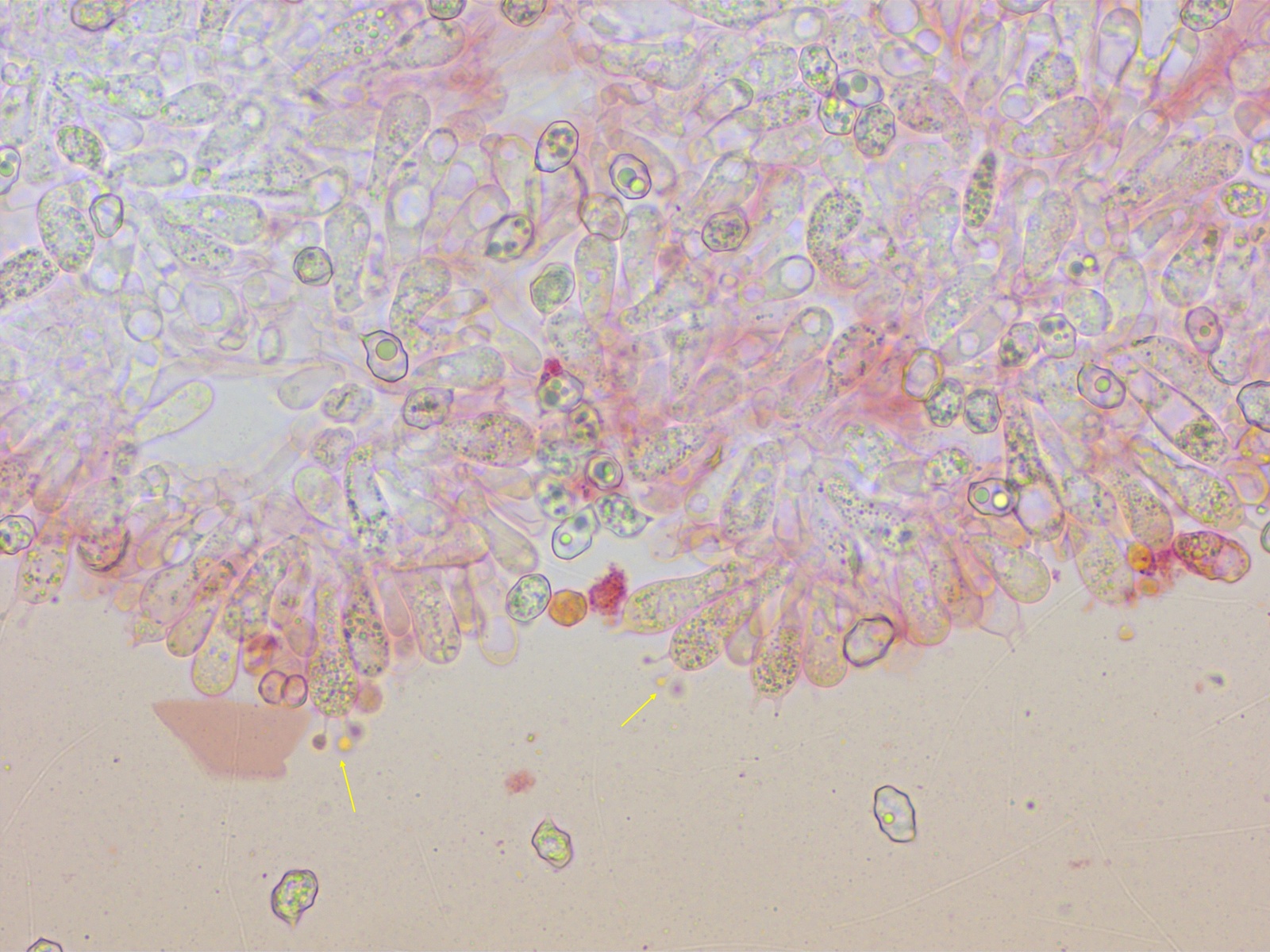
Später fand ich dann aber auch 4sporige Basidien, etwa 50/50 gemischt am gleichen Fruchtkörper.
Schnallen an der Basidienbasis vorhanden, aber selten und schwer zu finden.
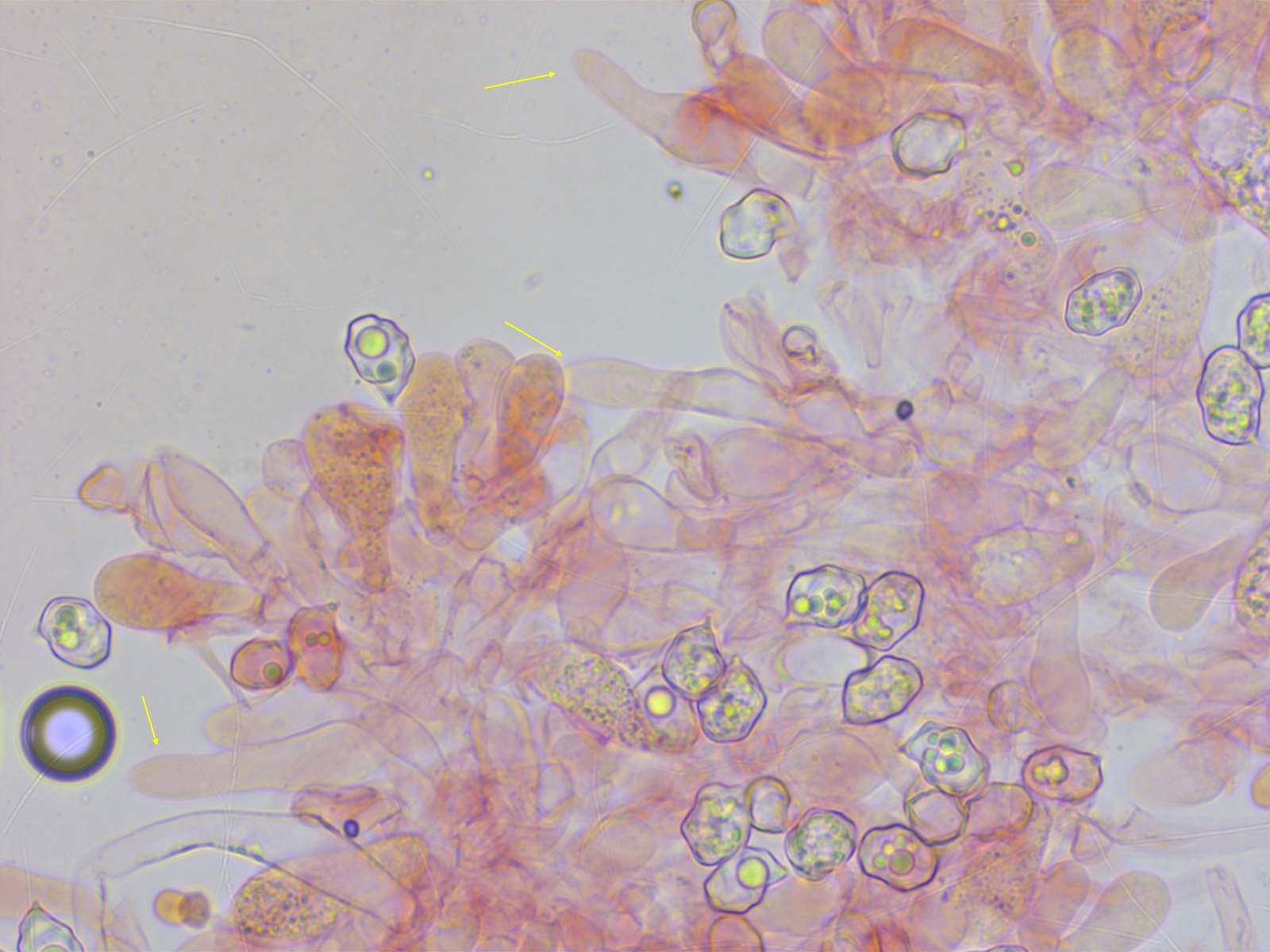
Cheilozystiden vorhanden, nicht viele, aber in jedem Präparat konnte ich welche finden. Einige davon zylindrisch oder subfusiform.
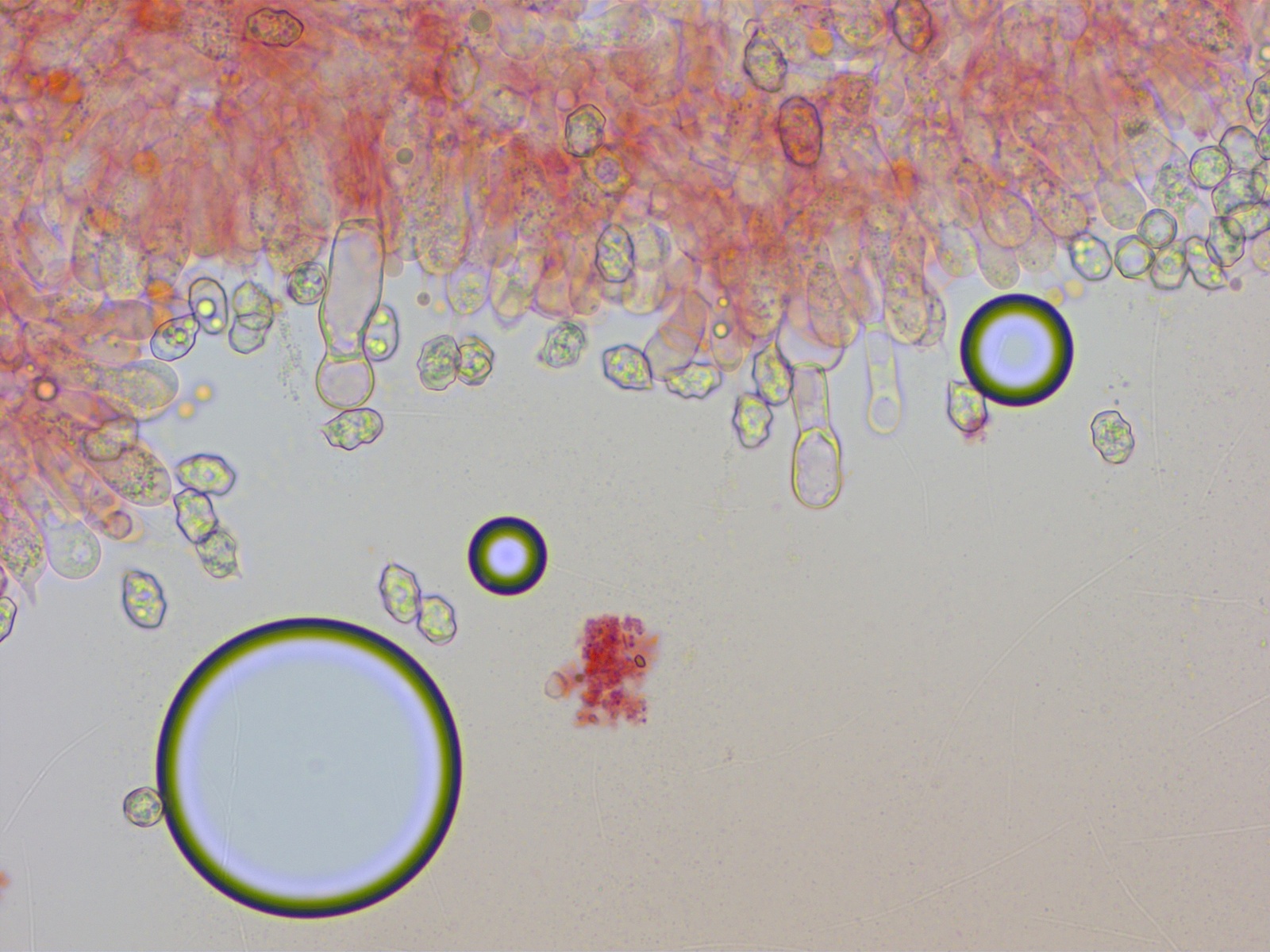
Meistens aber deutlich kopfig.
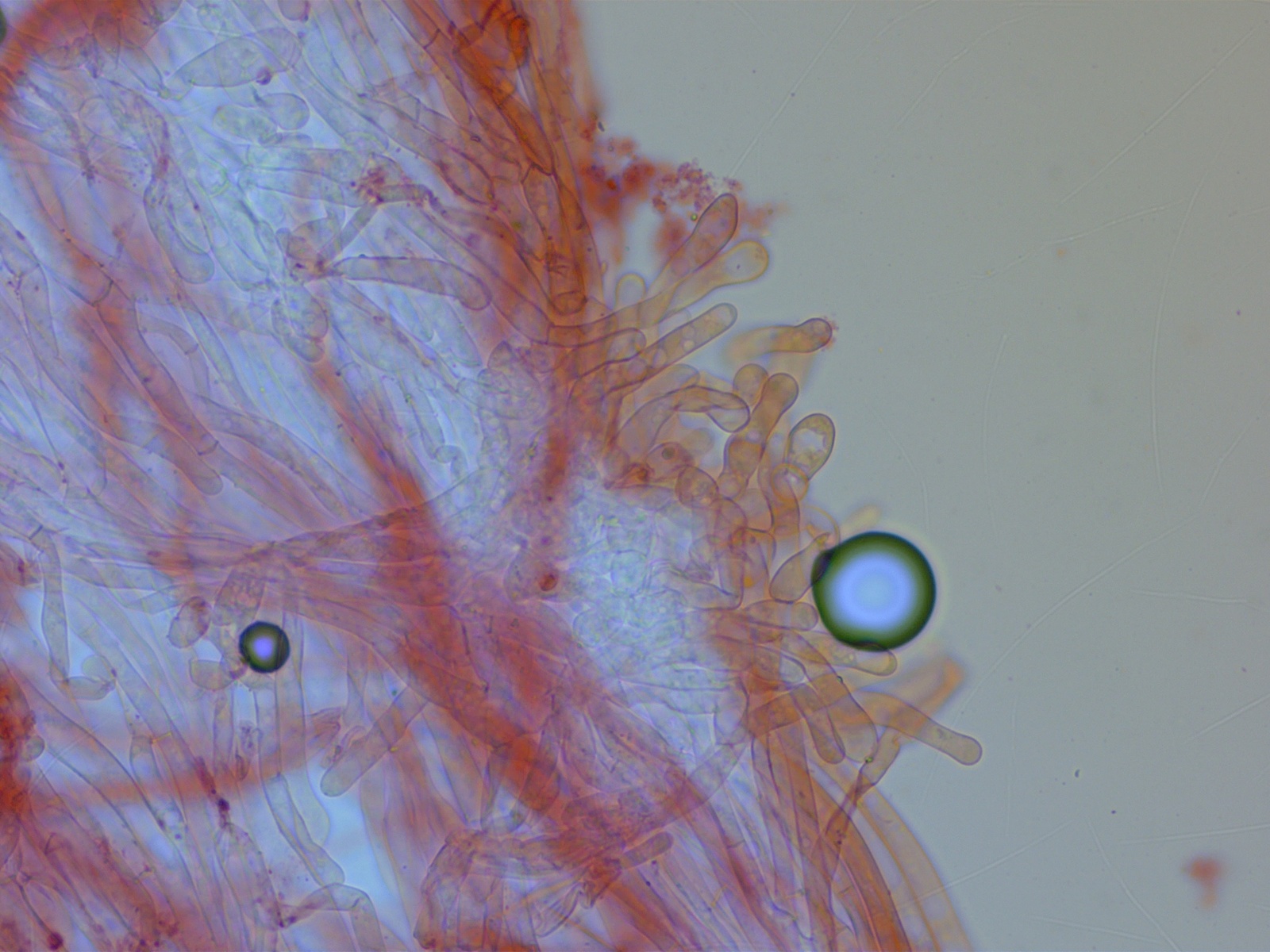
An der Stielspitze findet man viele kaulozystoides Elemente, zylindrisch oder leicht kopfig.
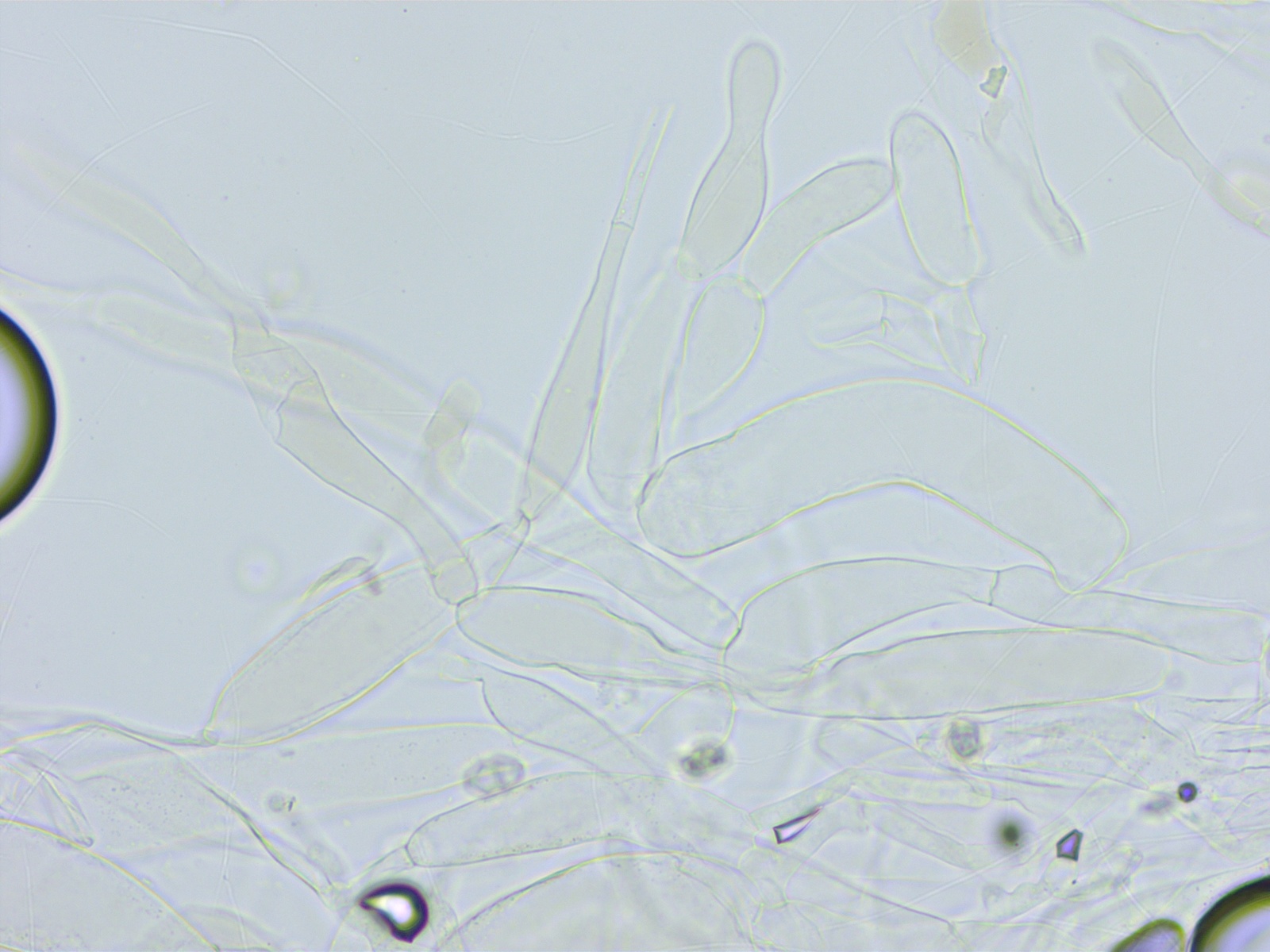
HDS mit schwachem, intrazellulären Pigment. Keine Inkrustationen, auch nicht in der Subkutis.
Nun habe ich hin und her geschlüsselt und habe viele Arten in Betracht gezogen, aber keine passt so richtig:
- E. queletii ist 4-sporig, sollte keine Schnallen haben, und eine sterile Lamellenschneide.
- E. cettoi könnte mikroskopisch einigermassen passen, ist aber auch 4-sporig, sollte aber nicht so kräftig gefärbt sein, und gehört eigentlich in den mediterranen Raum
- E. heterocystis würde in vielerlei Hinsicht auch gut passen, hat aber keine Schnallen und ist 4-sporig. Leider ist in der Mic. Veget. Medit. keine Abbildung.
- E. cremeoalbum hätte gemischt 4-/2-sporige Basidien, aber teils inkrustierte Hyphen und ist auch nicht so kräftig gefärbt (ob immer so?).
Vielleicht sehe ich den Wald vor lauter Bäumen nicht mehr und übersehe irgendeine andere Art. Was meint ihr?
Viele Grüsse
Raphael

