Hallo miteinander!
Am 30.12.23 fand ich diesen resupinaten Porling auf einer toten Eiche, die bei den aktuellen Stürmen um Weihnachten herum gefallen war. Weder mit GpBW noch Ryvardens "Poriod fungi of Europe" komme ich zu einem Resultat. Vielleicht könnt Ihr mir weiterhelfen?
Fundort:
MTB 7625-121; Ulmer Hochsträß, Spitalwald, 630 mNN; basischer Untergrund
in ursprüglich 12 m Höhe auf der Borke einer toten Eiche (Gesamthöhe des Torsos ca. 16 m), westseitig
Makroskopisch:
- rein resupinat wachsend
- bis zu 3 Lagen Fruchtschichten übereinander
- Porenschicht je Fruktifikation ca. 8 mm dick
- 17 – 19 Poren / 10 mm
- frisch rosa (KOH 20% graugrün), alt ocker-braun (KOH 20% rotbraun)
- Porenmündungen mit weißlichen Haaren, auf Druck gelbbraun
- vermutlich Weißfäule erzeugend
Mikroskopisch:
- alle Teile weder amyloid noch dextrinoid
- innerhalb des Hymenophors monomitisch (?), keine Schnallen gefunden
- Hyphen meist dickwandig, wenig verzweigt, teilw. "knorrig", nur wenige dünnwandige Septen
- keine Zystiden oder Seten gefunden
- 4-sporige Basidien
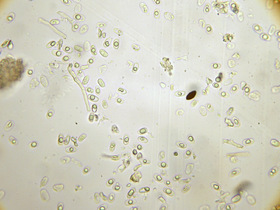
- Sporen ellipsoid, dickwandig, fein warzig/punktiert/rau, mit 1 (-2) Öltropfen
- Sporengröße: (7,3) 9,1 (10,1) x (3,8) 4,8 (6,0) ; Q = (1,6) 1,9 (2,2); n = 15



Auflicht: die ersten beiden Bilder 20x – Bildgröße entspr. 6 mm x 4 mm (bitte anklicken für volle Größe); 3. Bild: Zoom aus 80x – Haare an Porenmündung



Mikro: Sporen
1. Zoom aus 320x; 2. 800x, Sichtfeld-Ø 160 µm; 3. Versuch, das Ornament darzustellen in Kongorot, Zoom aus 800x
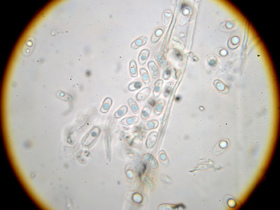

Mikro: Hyphen im Hymenophor, 800x, Sichtfeld-Ø 160 µm

Bei meinen Schlüsselversuchen habe ich auch mit "Sporen glatt", "dimitisch", "Hyphen mit Schnallen" probiert, aber ich bin immer nur im Nicht-Möglichen gelandet. Unter Verwendung der oben beschriebenen Merkmale kam ich in GpBW sowie Ryvarden auf "Lindtneria"... alles Quatsch.
Was hat soo große Sporen und soo große Poren, keine Schnallen, keine Zystiden... ???
In einer Antwort weitere Mikro-Bilder... bis gleich – Rika

